етерИум
Well-Known Member
Ми те по принцип много хора ми казват, че съм "като хванат от гората". Може и да ида!Е не знам кога де. Може и да греша.
Винаги може да отидеш в гората и да живееш там
Ми те по принцип много хора ми казват, че съм "като хванат от гората". Може и да ида!Е не знам кога де. Може и да греша.
Винаги може да отидеш в гората и да живееш там
Е що, нали чакаше да мине време да я усъвършенстват? Питам сериозно какви са доводите ти. Мани ги другите фейкове.Какво значи ''вече''? Не беше ли разработена и лани или чак сега смогнаха да я разработят?
Иначе на въпроса кратко и ясно: Не!
Добре, бе, @NovaPS, бе, бате, бе, кАжи ся: след като виждаш и сам опроверга поредното силно преувеличено - а в случая, направо невярно - твърдение за ваксината, след като виждаш и другите тук (примерно моите постове с графики от национални статистики за свръхсмъртност+рязко намаляване на раждаемостта), що не се вакснете у вас, не е ли по-добре?
Да се ваксинира още утре, днеска да си запише час. Ако е честна и искрена!!Е що, нали чакаше да мине време да я усъвършенстват? Питам сериозно какви са доводите ти. Мани ги другите фейкове.
Оооо! Ти (отчасти) се вписваш в профила на класически АНТИВАКСЪР! Дойчлянд, дойчлянд....Никога не съм се противогриповаксинирал. Не виждам причина на тоо етап да променям това.
Е кво толкова ви притеснява, кво се прайте? Аз 5-та доза и 3-ти бустер слагам оня ден. Ето ни тримата вакснати - мен, Тедката и Римайнда. Има ли ни нещо?Какво значи ''вече''? Не беше ли разработена и лани или чак сега смогнаха да я разработят?
Иначе на въпроса кратко и ясно: Не!
Екстра сте си. Забрави и $-ската, па и тестиса - все момци от сойЕ кво толкова ви притеснява, кво се прайте? Аз 5-та доза и 3-ти бустер слагам оня ден. Ето ни тримата вакснати - мен, Тедката и Римайнда. Има ли ни нещо?
И аз не съм. Какво общо има с Ковида това?Никога не съм се противогриповаксинирал. Не виждам причина на тоо етап да променям това.
Имаш ли препоръчителните ваксиниИ аз не съм. Какво общо има с Ковида това?
Да не забравим и ръководството.Екстра сте си. Забрави и $-ската, па и тестиса - все момци от сой
Това е в оригинал, не е моя подправка.Your post in the thread Ваксинирахте ли се ? was deleted. Причина: моля, без спувани
Понеделник в 16:03
Нявгъш коги немаше компютри по цял ден си ръчках касетофона - касетки, радио, записи. Някои радиа се хващаха перфектно, ама други не толкова. И най-добрата антена за тях беше ръката ми. Както и да я въртях тая антена и каквото и да закачах към нея, най-добър резултат все се получаваше като просто я докосна. Тялото е проводник, отвъте сме като краставички с преобладаващ процент вода. Никога не съм разбирал много от антени, но не ми се струва непосилна задача да се използва тялото като такава. Ти приемаш, че е нужна 1 см антена, което може да е така за всяко обикновено електронно устройство, но тези устройства обикновено са предназначени да работят в суха изолирана среда (въздуха наоколо е изолатор). Вътре в тялото на човека е съвсем друг свят от гледна точка на електронното устройство.Като инженер казвам, че е абсурдно наночип без антена да прави връзка с телефон наблизо. Поне 1 см. антена трябва.
Тедка, Тедка... 2 години и половина пишем у форума, и още не си разбрал, че от медицинска гледна точка някои хора не правим разлика между грип и Ковид. Забрави ли досадната фраза - "Ковид е просто грипче"?И аз не съм. Какво общо има с Ковида това?
Това е в оригинал, не е моя подправка.
Чипове с RFID комуникатор си виждал, дето плащат с имплант. 2-3 милиметра е, и работи само с нарочен карточетец.Тялото е проводник, отвъте сме като краставички с преобладаващ процент вода. Никога не съм разбирал много от антени, но не ми се струва непосилна задача да се използва тялото като такава. Ти приемаш, че е нужна 1 см антена, което може да е така за всяко обикновено електронно устройство, но тези устройства обикновено са предназначени да работят в суха изолирана среда (въздуха наоколо е изолатор). Вътре в тялото на човека е съвсем друг свят от гледна точка на електронното устройство.
И аз не съм. Какво общо има с Ковида това?
Това не е бизнес проект, това е форумче което го имаше преди години и никога не знам да е било за бизнес и печалба. Опитваш се да ме вкарваш във филми, които не съществуват. Май се обиди, че не те искам за първи мембър.Тебе искам за камшици.
Направи и малко пици,
че на гладно ни се пие,
ни камшик се бие.
Айде, бий си камшика към твоя форум вече. Нали си направи? Кво стана - никой ли няма там? Поредният провален бизнес проект, сигурно се самобичуваш. Затова ти е щукнало за камшиците.








 www.sciencedirect.com
www.sciencedirect.com
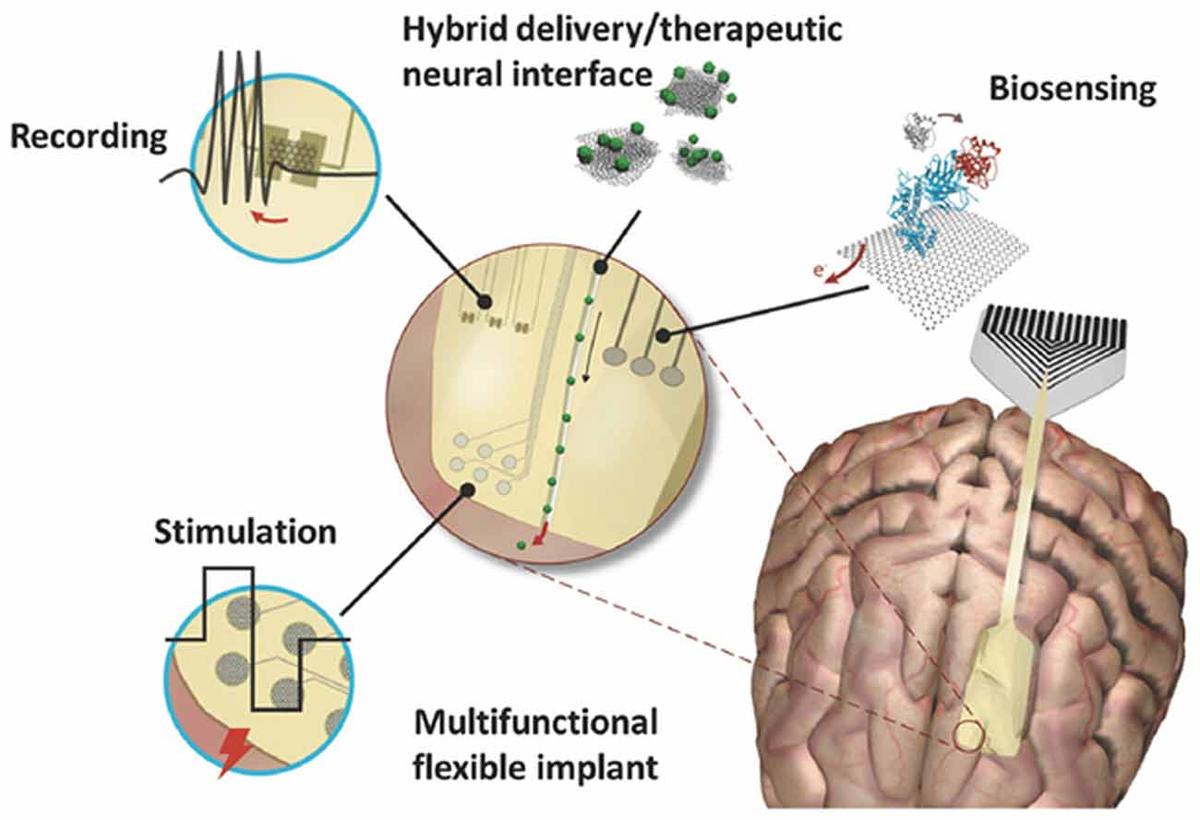



Какво внимание би предизвикал ако се беше ограничил само до първия абзац.Ние представяме двувалентни 3D ДНК оригами кубоиди като наистина монодисперсни колоиди и използваме тяхната способност за прецизна функционализация с дефинирани пластири и дефиниран брой супрамолекулни свързващи мотиви. Ние демонстрираме, че дори комплексите за включване на адамантан/β-циклодекстрин гостоприемник/гост с умерена сила на асоцииране могат да индуцират ефективна супраколоидна фибрилизация при високо разреждане на 3D ДНК оригами в резултат на кооперативна мултивалентност. Ние показваме подробности за сглобяването на Janus и не-Janus 3D ДНК оригами в супраколоидни хомо- и хетерофибрили по отношение на многовалентните ефекти, електростатичното скриниране и стехиометрията. Ние вярваме, че сливането на 3Д ДНК оригами с колоидни самосглобяващи се и супрамолекулни мотиви осигурява нови синергии в интерфейса на тези дисциплини, за да се разберат по-добре ефектите на многовалентността, да се насърчи структурната сложност и да се добавят механизми за сглобяване и превключване към ДНК нанонауката.
Супраколоидно самосглобяване на двувалентно Janus 3D ДНК оригами чрез програмируеми многовалентни взаимодействия хост/гост
Себастиан Льошер и проф. Андреас Валтер
Supracolloidal Self‐Assembly of Divalent Janus 3D DNA Origami via Programmable Multivalent Host/Guest Interactions - PMC
We introduce divalent 3D DNA origami cuboids as truly monodisperse colloids and harness their ability for precision functionalization with defined patches and defined numbers of supramolecular binding motifs. We demonstrate that even ...www.ncbi.nlm.nih.gov
3D ДНК оригами, базирано на решетка, е мощна и гъвкава техника за рационално проектиране и изграждане на произволно структурирани и монодисперсни 3D нанообекти, базирани на ДНК. Разчитайки на ненадминатата молекулярна програмируемост на специфична за последователност ДНК хибридизация, дълга единична верига на ДНК (наречена скеле) се сглобява с много къси едноверижни олигомери (наречени скоби), които организират скелето в 3D решетка в една стъпка, като по този начин което води до 3D структури от наночастици с най-висока прецизност при високи добиви. Приложенията на 3D ДНК оригами са все по-широко разпространени и взаимодействат с множество области на науката, например анизометрични или анизотропно функционализирани наночастици, фундаментални изследвания на образуването на суперструктури, биомедицина, (био)физика, сензори, и оптични материали. Този мини преглед обсъжда основите и последните постижения от формирането на структурата до избраните приложения, с мисия да насърчава междудисциплинарния обмен.
Ключови думи: ДНК нанонаука; ДНК оригами; анизотропни колоиди; наночастици; самосглобяване.
3D ДНК оригами наночастици: от основни принципи на проектиране до нововъзникващи приложения в меката материя и (био)нанонауките

3D DNA Origami Nanoparticles: From Basic Design Principles to Emerging Applications in Soft Matter and (Bio-)Nanosciences - PubMed
Scaffold-based lattice-engineered 3D DNA origami is a powerful and versatile technique for the rational design and build-up of arbitrarily structured and monodisperse DNA-based 3D nanoobjects. Relying on the unsurpassed molecular programmability of sequence-specific DNA hybridization, a long DNA...pubmed.ncbi.nlm.nih.gov
ДНК, генетичен материал, се използва в различни научни направления за различни биологични приложения, движени от ДНК нанотехнологиите през последните десетилетия, включително регенерация на тъкани, превенция на заболявания, инхибиране на възпаление, биоизобразяване, биосензиране, диагностика, доставка на противотуморни лекарства и терапия. С бързия напредък в ДНК нанотехнологиите бяха проектирани множество ДНК наноматериали с различна форма и размер на базата на класическото базово сдвояване на Watson-Crick за молекулярно самосглобяване. Някои ДНК материали могат функционално да променят клетъчното биологично поведение, като клетъчна миграция, клетъчна пролиферация, клетъчна диференциация, автофагия и противовъзпалителни ефекти. Някои едноверижни ДНК (ssDNA) или РНК с вторични структури чрез самосдвояване, наречени аптамер, притежават способността за насочване, които са избрани чрез системна еволюция на лиганди чрез експоненциално обогатяване (SELEX) и се прилагат за диагностика и лечение, насочени към тумор. Някои ДНК наноматериали с триизмерни (3D) наноструктури и стабилни структури се изследват като лекарствени носители за доставяне на множество антитуморни лекарства или генни терапевтични агенти. Въпреки че функционалните ДНК наноструктури насърчиха развитието на ДНК нанотехнологиите с иновативни дизайни и стратегии за подготовка и също така се доказаха с голям потенциал за биологична и медицинска употреба, все още има дълъг път за евентуалното реално приложение на ДНК материали живот. Тук в този преглед проведохме цялостно проучване на историята на структурното развитие на различни ДНК наноматериали, въведохме принципите на различни ДНК наноматериали, обобщихме биологичните им приложения в различни области и обсъдихме настоящите предизвикателства и по-нататъшните насоки, които биха могли да помогнат за постигането на техните приложения в бъдеще.
Биологичните приложения на ДНК наноматериалите: настоящи предизвикателства и бъдещи насоки

The biological applications of DNA nanomaterials: current challenges and future directions - PubMed
DNA, a genetic material, has been employed in different scientific directions for various biological applications as driven by DNA nanotechnology in the past decades, including tissue regeneration, disease prevention, inflammation inhibition, bioimaging, biosensing, diagnosis, antitumor drug...pubmed.ncbi.nlm.nih.gov
Мотивирано от сложни молекулярни мрежи от биологични организми, които позволяват контрол на времевите и пространствени концентрации на молекули, развитието отдолу нагоре на мрежи за изкуствени химични реакции получи подновен интерес от страна на биохимиците. Въз основа на хибридизация и реакции на изместване на веригата, базираните на ДНК мрежи за химични реакции (D-CRNs) осигуряват обещаващ метод за описание и анализ на (био)химични системи, в зависимост от тяхната висока програмируемост и насоченост. Тук се обсъжда напредъкът в разработването на D-CRN и се предоставя преглед на значими биохимични приложения, базирани на D-CRN, докладвани през последните десетилетия. Освен това се обсъждат възможностите и бъдещите насоки за изследване на D-CRN в биохимията.
Ключови думи: ДНК; ДНК разпознаване; биотехнология; мрежи за химични реакции; реакции на изместване на нишка.
Мрежи за химическа реакция, базирани на ДНК

DNA-Based Chemical Reaction Networks - PubMed
Motivated by complex molecular networks of biological organisms, which enable control of the temporal and spatial concentrations of molecules, the bottom-up development of artificial chemical reaction networks has received renewed interest from biochemists. Based on hybridization and...pubmed.ncbi.nlm.nih.gov
Биологичните и биохимичните системи са проявления на мрежи от химични реакции (CRN). Способността да се проектират и проектират такива мрежи може да позволи изграждането на изкуствени системи, които са толкова сложни, колкото тези, наблюдавани в биологията, отваряйки пътя към транслационни възможности, включително адаптивни материали. Едно място за напредък е проектирането на автономни системи, способни да генерират модели; въпреки това много синтетични CRN, като реакцията на Белоусов-Жаботински, не могат да бъдат пренастроени, за да кодират по-сложни взаимодействия и по този начин им липсва капацитет за по-подробни инженерни алгоритми. За разлика от това, ДНК е богата на информация молекула с предвидими и надеждни взаимодействия на сдвояване на основите и добре проучена кинетика, а използването на ДНК до голяма степен е позволило рационалното проектиране на много по-сложни синтетични CRN. Последните постижения в областта на ДНК изчисленията включват схеми за трансформация на шаблони, пример за самоорганизация. Арсенал от инструменти за проектиране на ДНК вериги за прилагане на различни CRN е разработен от ДНК нанотехнологи, включително софтуер за надеждно програмиране на вериги на нуклеинови киселини с изместване на вериги. В допълнение, ДНК проходилки могат да се използват за създаване на CRN с контролирана дифузия, докато ДНК геловете по подобен начин представляват нова среда за внедряване на CRN, което в крайна сметка може да доведе до разработването на интелигентни материали. Както ще твърдим, бъдещите усилия в генерирането на модели на базата на нуклеинова киселина ще бъдат най-много напреднали чрез използване на добре познати ензимни процеси, които да служат като генератори и усилватели. След като изчислителните инструменти на нуклеиновата киселина бъдат доразвити, за да се ускори процесът на проектиране на генерирането на модели, очакваме преход от любопитни доказателства за концепцията към проучвания, насочени към приложението.
Генериране на модели с мрежи за химическа реакция на нуклеинова киселина

Pattern Generation with Nucleic Acid Chemical Reaction Networks - PubMed
Biological and biochemical systems are manifestations of chemical reaction networks (CRNs). The ability to design and engineer such networks may allow the construction of artificial systems that are as complex as those seen in biology, opening the way to translational possibilities including...pubmed.ncbi.nlm.nih.gov
ДНК се превърна в един от най-широко използваните молекулярни градивни елементи за инженерни самосглобяващи се материали. ДНК оригами е техника, която използва стотици къси ДНК олигонуклеотиди, наречени щапелни нишки, за да сгъне дълга едноверижна ДНК, която се нарича верига на скеле, в различни дизайнерски наномащабни архитектури. ДНК оригами драматично подобри сложността и мащабируемостта на ДНК наноструктурите. Благодарение на високата си степен на персонализиране и пространствена адресируемост, ДНК оригами предоставя гъвкава платформа, с която да се проектират наномащабни структури и устройства, които могат да усещат, изчисляват и задействат. Тези способности разкриват възможности за широк спектър от приложения в химията, биологията, физиката, материалознанието, и компютърни науки, които често изискват програмиран пространствен контрол на молекули и атоми в триизмерно (3D) пространство. Този преглед предоставя цялостен преглед на последните разработки в структурата, дизайна, сглобяването и насоченото самосглобяване на ДНК оригами, както и неговите широки приложения.
ДНК оригами: Скелета за създаване на структури от по-висок ред

DNA Origami: Scaffolds for Creating Higher Order Structures - PubMed
DNA has become one of the most extensively used molecular building blocks for engineering self-assembling materials. DNA origami is a technique that uses hundreds of short DNA oligonucleotides, called staple strands, to fold a long single-stranded DNA, which is called a scaffold strand, into...pubmed.ncbi.nlm.nih.gov
Естествени биомолекулни сглобки като молекулярни двигатели, ензими, вируси и субклетъчни структури често се образуват чрез самоограничаваща се йерархична олигомеризация на множество субединици. Големите структури също могат да се сглобяват ефективно от няколко компонента чрез комбиниране на йерархично сглобяване и симетрия, стратегия, илюстрирана от вирусни капсиди. De novo протеиновият дизайн и РНК и ДНК нанотехнологиите имат за цел да имитират тези способности, но изграждането отдолу нагоре на изкуствени структури с размерите и сложността на вируси и други субклетъчни компоненти остава предизвикателство. Тук показваме, че принципите на естествено сглобяване могат да се комбинират с методите на ДНК оригами за производство на структури в мащаб на гигадалтон с контролирани размери. Информацията за ДНК последователността се използва за кодиране на формите на отделните ДНК оригами градивни елементи, и геометрията и детайлите на взаимодействията между тези градивни блокове след това контролират техните номера на копия, позиции и ориентации в сглобките от по-висок ред. Ние илюстрираме тази стратегия, като създаваме равнинни пръстени с диаметър до 350 нанометра и с атомни маси до 330 мегадалтона, дълги микрометри, дебели тръби, съизмерими по размер с някои бацили, и триизмерни полиедрични сглобки с размери до 1,2 гигадалтона и 450 нанометра в диаметър. Ние постигаме ефективно сглобяване с добив до 90 процента, като използваме градивни елементи с валидирана структура и достатъчна твърдост и точен дизайн с мотиви за взаимодействие, които гарантират, че йерархичното сглобяване е самоограничаващо се и може да продължи в равновесие, за да позволи корекция на грешка. Очакваме, че нашият метод, който позволява самостоятелно сглобяване на структури с размери, близки до тези на вируси и клетъчни органели, може лесно да се използва за създаване на редица други сложни структури с добре дефинирани размери, като се използва модулността и високата степен на адресируемост на използваните градивни елементи на ДНК оригами.
ДНК сглобки с програмируема форма в мащаб на Гигадалтон

Gigadalton-scale shape-programmable DNA assemblies - PubMed
Natural biomolecular assemblies such as molecular motors, enzymes, viruses and subcellular structures often form by self-limiting hierarchical oligomerization of multiple subunits. Large structures can also assemble efficiently from a few components by combining hierarchical assembly and...pubmed.ncbi.nlm.nih.gov
Самосглобяването на ДНК се увеличи

Базираните на въглерод функционални наноматериали привлякоха огромен научен интерес от много дисциплини и, поради своите изключителни свойства, предложиха огромен потенциал в разнообразни приложения. Сред различните въглеродни наноматериали графенът е един от най-новите и се смята за най-важният. Графенът, монослоен материал, съставен от sp 2 -хибридизирани въглеродни атоми, подредени шестоъгълно в двуизмерна структура, може лесно да бъде функционализиран чрез химическа модификация. Функционализираният графен и неговите производни са използвани в различни нано-биотехнологични приложения, като екологично инженерство, биомедицина и биотехнологии. Въпреки това, перспективното използване на материали, свързани с графен, в биологичен контекст изисква подробно разбиране на тези материали, което е от съществено значение за разширяване на техните биомедицински приложения в бъдеще. През последните години броят на биологичните изследвания, включващи наноматериали, свързани с графен, бързо се увеличи. Тези проучвания са документирали ефектите от биологичните взаимодействия между свързаните с графен материали и различни организационни нива на живи системи, вариращи от биомолекули до животни. В настоящия преглед ще обобщим скорошния напредък в разбирането главно на взаимодействията между графен и клетки.
6 . Изводи, предизвикателства и бъдещи перспективи
От откриването му през 2004 г. е постигнат значителен напредък в разработването на графен и свързаните с графен материали. Те са показали широк спектър от потенциални приложения в различни области, включително електроника, енергийно инженерство и биомедицина. Напоследък броят на биологичните изследвания, включващи материали, свързани с графен, бързо се увеличи, в които бяха документирани ефектите от биологичните взаимодействия между графен и живи системи. В настоящия преглед ние се фокусираме върху молекулярните механизми, лежащи в основата на взаимодействията между свързаните с графен наноматериали и клетки и предоставяме систематичен преглед на това как графенът може да взаимодейства с биомолекулите, да пресича плазмената мембрана, да се премества в рамките на ендозомните/лизозомните системи и да влияе на ключови клетъчни компоненти, включително митохондрия, ядро и цитоскелет
Взаимодействия на графен с клетки на бозайници: Молекулярни механизми и биомедицински прозрения

Interactions of graphene with mammalian cells: Molecular mechanisms and biomedical insights
Carbon-based functional nanomaterials have attracted immense scientific interest from many disciplines and, due to their extraordinary properties, hav…www.sciencedirect.com
Научната общност е свидетел на експоненциално нарастване на приложенията на графен и базирани на графен материали в широк спектър от области, от инженерство до електроника до биотехнологии и биомедицински приложения. Що се отнася до неврологията, интересът, предизвикан от тези материали, е двоен. От една страна, нанолистове, направени от графен или производни на графен (графенов оксид или неговата редуцирана форма), могат да се използват като носители за доставяне на лекарства. Тук важен аспект е да се оцени тяхната токсичност, която силно зависи от състава на люспите, химическата функционалност и размерите. От друга страна, графенът може да се използва като субстрат за тъканно инженерство. В този случай проводимостта е може би най-подходящата сред различните свойства на различните графенови материали, тъй като може да позволи да се инструктират и разпитват невронни мрежи, както и да се стимулира невронният растеж и диференциация, което има голям потенциал в регенеративната медицина. В този преглед се опитваме да дадем цялостен поглед върху постиженията и новите предизвикателства в областта, както и кои според нас са най-вълнуващите посоки, които да поемем в близко бъдеще. Те включват необходимостта да се проектират многофункционални наночастици (NPs), способни да преминат през кръвно-мозъчната бариера, за да достигнат до нервните клетки и да постигнат доставка при поискване на специфични лекарства. Ние описваме състоянието на техниката в използването на графенови материали за проектиране на триизмерни скелета за стимулиране на растежа и регенерацията на невроните ние се опитваме да дадем цялостен поглед върху постиженията и новите предизвикателства в областта, както и кои според нас са най-вълнуващите посоки, които да поемем в близко бъдеще. Те включват необходимостта да се проектират многофункционални наночастици (NPs), способни да преминат през кръвно-мозъчната бариера, за да достигнат до нервните клетки и да постигнат доставка при поискване на специфични лекарства. Ние описваме състоянието на техниката в използването на графенови материали за проектиране на триизмерни скелета за стимулиране на растежа и регенерацията на невроните ние се опитваме да дадем цялостен поглед върху постиженията и новите предизвикателства в областта, както и кои според нас са най-вълнуващите посоки, които да поемем в близко бъдеще. Те включват необходимостта да се проектират многофункционални наночастици (NPs), способни да преминат през кръвно-мозъчната бариера, за да достигнат до нервните клетки и да постигнат доставка при поискване на специфични лекарства. Ние описваме състоянието на техниката в използването на графенови материали за проектиране на триизмерни скелета за стимулиране на растежа и регенерацията на невроните и за постигане на доставка при поискване на конкретни лекарства. Ние описваме състоянието на техниката в използването на графенови материали за проектиране на триизмерни скелета за стимулиране на растежа и регенерацията на невроните и за постигане на доставка при поискване на конкретни лекарства. Ние описваме състоянието на техниката в използването на графенови материали за проектиране на триизмерни скелета за стимулиране на растежа и регенерацията на невронитеin vivo и възможността за използване на графен като компонент на хибридни композити/многослойни органични електронни устройства. Не на последно място, ние обръщаме внимание на необходимостта от точно теоретично моделиране на интерфейса между графен и биологичен материал, като моделираме взаимодействието на графен с протеини и клетъчни мембрани в наноразмер и описваме физическия механизъм(и) на пренос на заряд чрез които различните графенови материали могат да повлияят на възбудимостта и физиологията на нервните клетки.
Взаимодействие на базирани на графен материали с невронни клетки

Frontiers | Interfacing Graphene-Based Materials With Neural Cells
The scientific community has witnessed an exponential increase in the applications of graphene and graphene-based materials in a wide range of fields, from e...www.frontiersin.org
Последният напредък в наноматериалите и нанотехнологиите проправи пътя за изграждане на интегрирани устройства с нанометричен размер, наречени нано възли. Тези нано-възли са съставени от нано-процесор, нано-памет, нано-батерии, нано-предавател, нано-антена и нано-сензори, които работят на наномащабно ниво. Те са в състояние да изпълняват прости задачи, като усещане, изчисление и задействане. Взаимната връзка между микроустройствата и нановъзлите/наносензорите позволи разработването на нов мрежов стандарт, наречен Wireless Nano-Sensors Network (WNSN). Този документ предоставя задълбочен преглед на WNSN, неговите архитектури, области на приложение и предизвикателства, които трябва да бъдат адресирани, като същевременно идентифицира възможности за тяхното внедряване в различни области на приложение.






Електромагнитна базирана безжична нано-сензорна мрежа: архитектури и приложения
---
Този кратък фактчек не откри никакви доказателства за чип във ваксината.
Ваксинирайте се.
Прочетох го и не виждам много общо с ваксината? Няма как да се спре развитието и да искаш.Ние представяме двувалентни 3D ДНК оригами кубоиди като наистина монодисперсни колоиди и използваме тяхната способност за прецизна функционализация с дефинирани пластири и дефиниран брой супрамолекулни свързващи мотиви. Ние демонстрираме, че дори комплексите за включване на адамантан/β-циклодекстрин гостоприемник/гост с умерена сила на асоцииране могат да индуцират ефективна супраколоидна фибрилизация при високо разреждане на 3D ДНК оригами в резултат на кооперативна мултивалентност. Ние показваме подробности за сглобяването на Janus и не-Janus 3D ДНК оригами в супраколоидни хомо- и хетерофибрили по отношение на многовалентните ефекти, електростатичното скриниране и стехиометрията. Ние вярваме, че сливането на 3Д ДНК оригами с колоидни самосглобяващи се и супрамолекулни мотиви осигурява нови синергии в интерфейса на тези дисциплини, за да се разберат по-добре ефектите на многовалентността, да се насърчи структурната сложност и да се добавят механизми за сглобяване и превключване към ДНК нанонауката.
Супраколоидно самосглобяване на двувалентно Janus 3D ДНК оригами чрез програмируеми многовалентни взаимодействия хост/гост
Себастиан Льошер и проф. Андреас Валтер
Supracolloidal Self‐Assembly of Divalent Janus 3D DNA Origami via Programmable Multivalent Host/Guest Interactions - PMC
We introduce divalent 3D DNA origami cuboids as truly monodisperse colloids and harness their ability for precision functionalization with defined patches and defined numbers of supramolecular binding motifs. We demonstrate that even ...www.ncbi.nlm.nih.gov
3D ДНК оригами, базирано на решетка, е мощна и гъвкава техника за рационално проектиране и изграждане на произволно структурирани и монодисперсни 3D нанообекти, базирани на ДНК. Разчитайки на ненадминатата молекулярна програмируемост на специфична за последователност ДНК хибридизация, дълга единична верига на ДНК (наречена скеле) се сглобява с много къси едноверижни олигомери (наречени скоби), които организират скелето в 3D решетка в една стъпка, като по този начин което води до 3D структури от наночастици с най-висока прецизност при високи добиви. Приложенията на 3D ДНК оригами са все по-широко разпространени и взаимодействат с множество области на науката, например анизометрични или анизотропно функционализирани наночастици, фундаментални изследвания на образуването на суперструктури, биомедицина, (био)физика, сензори, и оптични материали. Този мини преглед обсъжда основите и последните постижения от формирането на структурата до избраните приложения, с мисия да насърчава междудисциплинарния обмен.
Ключови думи: ДНК нанонаука; ДНК оригами; анизотропни колоиди; наночастици; самосглобяване.
3D ДНК оригами наночастици: от основни принципи на проектиране до нововъзникващи приложения в меката материя и (био)нанонауките

3D DNA Origami Nanoparticles: From Basic Design Principles to Emerging Applications in Soft Matter and (Bio-)Nanosciences - PubMed
Scaffold-based lattice-engineered 3D DNA origami is a powerful and versatile technique for the rational design and build-up of arbitrarily structured and monodisperse DNA-based 3D nanoobjects. Relying on the unsurpassed molecular programmability of sequence-specific DNA hybridization, a long DNA...pubmed.ncbi.nlm.nih.gov
ДНК, генетичен материал, се използва в различни научни направления за различни биологични приложения, движени от ДНК нанотехнологиите през последните десетилетия, включително регенерация на тъкани, превенция на заболявания, инхибиране на възпаление, биоизобразяване, биосензиране, диагностика, доставка на противотуморни лекарства и терапия. С бързия напредък в ДНК нанотехнологиите бяха проектирани множество ДНК наноматериали с различна форма и размер на базата на класическото базово сдвояване на Watson-Crick за молекулярно самосглобяване. Някои ДНК материали могат функционално да променят клетъчното биологично поведение, като клетъчна миграция, клетъчна пролиферация, клетъчна диференциация, автофагия и противовъзпалителни ефекти. Някои едноверижни ДНК (ssDNA) или РНК с вторични структури чрез самосдвояване, наречени аптамер, притежават способността за насочване, които са избрани чрез системна еволюция на лиганди чрез експоненциално обогатяване (SELEX) и се прилагат за диагностика и лечение, насочени към тумор. Някои ДНК наноматериали с триизмерни (3D) наноструктури и стабилни структури се изследват като лекарствени носители за доставяне на множество антитуморни лекарства или генни терапевтични агенти. Въпреки че функционалните ДНК наноструктури насърчиха развитието на ДНК нанотехнологиите с иновативни дизайни и стратегии за подготовка и също така се доказаха с голям потенциал за биологична и медицинска употреба, все още има дълъг път за евентуалното реално приложение на ДНК материали живот. Тук в този преглед проведохме цялостно проучване на историята на структурното развитие на различни ДНК наноматериали, въведохме принципите на различни ДНК наноматериали, обобщихме биологичните им приложения в различни области и обсъдихме настоящите предизвикателства и по-нататъшните насоки, които биха могли да помогнат за постигането на техните приложения в бъдеще.
Биологичните приложения на ДНК наноматериалите: настоящи предизвикателства и бъдещи насоки

The biological applications of DNA nanomaterials: current challenges and future directions - PubMed
DNA, a genetic material, has been employed in different scientific directions for various biological applications as driven by DNA nanotechnology in the past decades, including tissue regeneration, disease prevention, inflammation inhibition, bioimaging, biosensing, diagnosis, antitumor drug...pubmed.ncbi.nlm.nih.gov
Мотивирано от сложни молекулярни мрежи от биологични организми, които позволяват контрол на времевите и пространствени концентрации на молекули, развитието отдолу нагоре на мрежи за изкуствени химични реакции получи подновен интерес от страна на биохимиците. Въз основа на хибридизация и реакции на изместване на веригата, базираните на ДНК мрежи за химични реакции (D-CRNs) осигуряват обещаващ метод за описание и анализ на (био)химични системи, в зависимост от тяхната висока програмируемост и насоченост. Тук се обсъжда напредъкът в разработването на D-CRN и се предоставя преглед на значими биохимични приложения, базирани на D-CRN, докладвани през последните десетилетия. Освен това се обсъждат възможностите и бъдещите насоки за изследване на D-CRN в биохимията.
Ключови думи: ДНК; ДНК разпознаване; биотехнология; мрежи за химични реакции; реакции на изместване на нишка.
Мрежи за химическа реакция, базирани на ДНК

DNA-Based Chemical Reaction Networks - PubMed
Motivated by complex molecular networks of biological organisms, which enable control of the temporal and spatial concentrations of molecules, the bottom-up development of artificial chemical reaction networks has received renewed interest from biochemists. Based on hybridization and...pubmed.ncbi.nlm.nih.gov
Биологичните и биохимичните системи са проявления на мрежи от химични реакции (CRN). Способността да се проектират и проектират такива мрежи може да позволи изграждането на изкуствени системи, които са толкова сложни, колкото тези, наблюдавани в биологията, отваряйки пътя към транслационни възможности, включително адаптивни материали. Едно място за напредък е проектирането на автономни системи, способни да генерират модели; въпреки това много синтетични CRN, като реакцията на Белоусов-Жаботински, не могат да бъдат пренастроени, за да кодират по-сложни взаимодействия и по този начин им липсва капацитет за по-подробни инженерни алгоритми. За разлика от това, ДНК е богата на информация молекула с предвидими и надеждни взаимодействия на сдвояване на основите и добре проучена кинетика, а използването на ДНК до голяма степен е позволило рационалното проектиране на много по-сложни синтетични CRN. Последните постижения в областта на ДНК изчисленията включват схеми за трансформация на шаблони, пример за самоорганизация. Арсенал от инструменти за проектиране на ДНК вериги за прилагане на различни CRN е разработен от ДНК нанотехнологи, включително софтуер за надеждно програмиране на вериги на нуклеинови киселини с изместване на вериги. В допълнение, ДНК проходилки могат да се използват за създаване на CRN с контролирана дифузия, докато ДНК геловете по подобен начин представляват нова среда за внедряване на CRN, което в крайна сметка може да доведе до разработването на интелигентни материали. Както ще твърдим, бъдещите усилия в генерирането на модели на базата на нуклеинова киселина ще бъдат най-много напреднали чрез използване на добре познати ензимни процеси, които да служат като генератори и усилватели. След като изчислителните инструменти на нуклеиновата киселина бъдат доразвити, за да се ускори процесът на проектиране на генерирането на модели, очакваме преход от любопитни доказателства за концепцията към проучвания, насочени към приложението.
Генериране на модели с мрежи за химическа реакция на нуклеинова киселина

Pattern Generation with Nucleic Acid Chemical Reaction Networks - PubMed
Biological and biochemical systems are manifestations of chemical reaction networks (CRNs). The ability to design and engineer such networks may allow the construction of artificial systems that are as complex as those seen in biology, opening the way to translational possibilities including...pubmed.ncbi.nlm.nih.gov
ДНК се превърна в един от най-широко използваните молекулярни градивни елементи за инженерни самосглобяващи се материали. ДНК оригами е техника, която използва стотици къси ДНК олигонуклеотиди, наречени щапелни нишки, за да сгъне дълга едноверижна ДНК, която се нарича верига на скеле, в различни дизайнерски наномащабни архитектури. ДНК оригами драматично подобри сложността и мащабируемостта на ДНК наноструктурите. Благодарение на високата си степен на персонализиране и пространствена адресируемост, ДНК оригами предоставя гъвкава платформа, с която да се проектират наномащабни структури и устройства, които могат да усещат, изчисляват и задействат. Тези способности разкриват възможности за широк спектър от приложения в химията, биологията, физиката, материалознанието, и компютърни науки, които често изискват програмиран пространствен контрол на молекули и атоми в триизмерно (3D) пространство. Този преглед предоставя цялостен преглед на последните разработки в структурата, дизайна, сглобяването и насоченото самосглобяване на ДНК оригами, както и неговите широки приложения.
ДНК оригами: Скелета за създаване на структури от по-висок ред

DNA Origami: Scaffolds for Creating Higher Order Structures - PubMed
DNA has become one of the most extensively used molecular building blocks for engineering self-assembling materials. DNA origami is a technique that uses hundreds of short DNA oligonucleotides, called staple strands, to fold a long single-stranded DNA, which is called a scaffold strand, into...pubmed.ncbi.nlm.nih.gov
Естествени биомолекулни сглобки като молекулярни двигатели, ензими, вируси и субклетъчни структури често се образуват чрез самоограничаваща се йерархична олигомеризация на множество субединици. Големите структури също могат да се сглобяват ефективно от няколко компонента чрез комбиниране на йерархично сглобяване и симетрия, стратегия, илюстрирана от вирусни капсиди. De novo протеиновият дизайн и РНК и ДНК нанотехнологиите имат за цел да имитират тези способности, но изграждането отдолу нагоре на изкуствени структури с размерите и сложността на вируси и други субклетъчни компоненти остава предизвикателство. Тук показваме, че принципите на естествено сглобяване могат да се комбинират с методите на ДНК оригами за производство на структури в мащаб на гигадалтон с контролирани размери. Информацията за ДНК последователността се използва за кодиране на формите на отделните ДНК оригами градивни елементи, и геометрията и детайлите на взаимодействията между тези градивни блокове след това контролират техните номера на копия, позиции и ориентации в сглобките от по-висок ред. Ние илюстрираме тази стратегия, като създаваме равнинни пръстени с диаметър до 350 нанометра и с атомни маси до 330 мегадалтона, дълги микрометри, дебели тръби, съизмерими по размер с някои бацили, и триизмерни полиедрични сглобки с размери до 1,2 гигадалтона и 450 нанометра в диаметър. Ние постигаме ефективно сглобяване с добив до 90 процента, като използваме градивни елементи с валидирана структура и достатъчна твърдост и точен дизайн с мотиви за взаимодействие, които гарантират, че йерархичното сглобяване е самоограничаващо се и може да продължи в равновесие, за да позволи корекция на грешка. Очакваме, че нашият метод, който позволява самостоятелно сглобяване на структури с размери, близки до тези на вируси и клетъчни органели, може лесно да се използва за създаване на редица други сложни структури с добре дефинирани размери, като се използва модулността и високата степен на адресируемост на използваните градивни елементи на ДНК оригами.
ДНК сглобки с програмируема форма в мащаб на Гигадалтон

Gigadalton-scale shape-programmable DNA assemblies - PubMed
Natural biomolecular assemblies such as molecular motors, enzymes, viruses and subcellular structures often form by self-limiting hierarchical oligomerization of multiple subunits. Large structures can also assemble efficiently from a few components by combining hierarchical assembly and...pubmed.ncbi.nlm.nih.gov
Самосглобяването на ДНК се увеличи

Базираните на въглерод функционални наноматериали привлякоха огромен научен интерес от много дисциплини и, поради своите изключителни свойства, предложиха огромен потенциал в разнообразни приложения. Сред различните въглеродни наноматериали графенът е един от най-новите и се смята за най-важният. Графенът, монослоен материал, съставен от sp 2 -хибридизирани въглеродни атоми, подредени шестоъгълно в двуизмерна структура, може лесно да бъде функционализиран чрез химическа модификация. Функционализираният графен и неговите производни са използвани в различни нано-биотехнологични приложения, като екологично инженерство, биомедицина и биотехнологии. Въпреки това, перспективното използване на материали, свързани с графен, в биологичен контекст изисква подробно разбиране на тези материали, което е от съществено значение за разширяване на техните биомедицински приложения в бъдеще. През последните години броят на биологичните изследвания, включващи наноматериали, свързани с графен, бързо се увеличи. Тези проучвания са документирали ефектите от биологичните взаимодействия между свързаните с графен материали и различни организационни нива на живи системи, вариращи от биомолекули до животни. В настоящия преглед ще обобщим скорошния напредък в разбирането главно на взаимодействията между графен и клетки.
6 . Изводи, предизвикателства и бъдещи перспективи
От откриването му през 2004 г. е постигнат значителен напредък в разработването на графен и свързаните с графен материали. Те са показали широк спектър от потенциални приложения в различни области, включително електроника, енергийно инженерство и биомедицина. Напоследък броят на биологичните изследвания, включващи материали, свързани с графен, бързо се увеличи, в които бяха документирани ефектите от биологичните взаимодействия между графен и живи системи. В настоящия преглед ние се фокусираме върху молекулярните механизми, лежащи в основата на взаимодействията между свързаните с графен наноматериали и клетки и предоставяме систематичен преглед на това как графенът може да взаимодейства с биомолекулите, да пресича плазмената мембрана, да се премества в рамките на ендозомните/лизозомните системи и да влияе на ключови клетъчни компоненти, включително митохондрия, ядро и цитоскелет
Взаимодействия на графен с клетки на бозайници: Молекулярни механизми и биомедицински прозрения

Interactions of graphene with mammalian cells: Molecular mechanisms and biomedical insights
Carbon-based functional nanomaterials have attracted immense scientific interest from many disciplines and, due to their extraordinary properties, hav…www.sciencedirect.com
Научната общност е свидетел на експоненциално нарастване на приложенията на графен и базирани на графен материали в широк спектър от области, от инженерство до електроника до биотехнологии и биомедицински приложения. Що се отнася до неврологията, интересът, предизвикан от тези материали, е двоен. От една страна, нанолистове, направени от графен или производни на графен (графенов оксид или неговата редуцирана форма), могат да се използват като носители за доставяне на лекарства. Тук важен аспект е да се оцени тяхната токсичност, която силно зависи от състава на люспите, химическата функционалност и размерите. От друга страна, графенът може да се използва като субстрат за тъканно инженерство. В този случай проводимостта е може би най-подходящата сред различните свойства на различните графенови материали, тъй като може да позволи да се инструктират и разпитват невронни мрежи, както и да се стимулира невронният растеж и диференциация, което има голям потенциал в регенеративната медицина. В този преглед се опитваме да дадем цялостен поглед върху постиженията и новите предизвикателства в областта, както и кои според нас са най-вълнуващите посоки, които да поемем в близко бъдеще. Те включват необходимостта да се проектират многофункционални наночастици (NPs), способни да преминат през кръвно-мозъчната бариера, за да достигнат до нервните клетки и да постигнат доставка при поискване на специфични лекарства. Ние описваме състоянието на техниката в използването на графенови материали за проектиране на триизмерни скелета за стимулиране на растежа и регенерацията на невроните ние се опитваме да дадем цялостен поглед върху постиженията и новите предизвикателства в областта, както и кои според нас са най-вълнуващите посоки, които да поемем в близко бъдеще. Те включват необходимостта да се проектират многофункционални наночастици (NPs), способни да преминат през кръвно-мозъчната бариера, за да достигнат до нервните клетки и да постигнат доставка при поискване на специфични лекарства. Ние описваме състоянието на техниката в използването на графенови материали за проектиране на триизмерни скелета за стимулиране на растежа и регенерацията на невроните ние се опитваме да дадем цялостен поглед върху постиженията и новите предизвикателства в областта, както и кои според нас са най-вълнуващите посоки, които да поемем в близко бъдеще. Те включват необходимостта да се проектират многофункционални наночастици (NPs), способни да преминат през кръвно-мозъчната бариера, за да достигнат до нервните клетки и да постигнат доставка при поискване на специфични лекарства. Ние описваме състоянието на техниката в използването на графенови материали за проектиране на триизмерни скелета за стимулиране на растежа и регенерацията на невроните и за постигане на доставка при поискване на конкретни лекарства. Ние описваме състоянието на техниката в използването на графенови материали за проектиране на триизмерни скелета за стимулиране на растежа и регенерацията на невроните и за постигане на доставка при поискване на конкретни лекарства. Ние описваме състоянието на техниката в използването на графенови материали за проектиране на триизмерни скелета за стимулиране на растежа и регенерацията на невронитеin vivo и възможността за използване на графен като компонент на хибридни композити/многослойни органични електронни устройства. Не на последно място, ние обръщаме внимание на необходимостта от точно теоретично моделиране на интерфейса между графен и биологичен материал, като моделираме взаимодействието на графен с протеини и клетъчни мембрани в наноразмер и описваме физическия механизъм(и) на пренос на заряд чрез които различните графенови материали могат да повлияят на възбудимостта и физиологията на нервните клетки.
Взаимодействие на базирани на графен материали с невронни клетки

Frontiers | Interfacing Graphene-Based Materials With Neural Cells
The scientific community has witnessed an exponential increase in the applications of graphene and graphene-based materials in a wide range of fields, from e...www.frontiersin.org
Последният напредък в наноматериалите и нанотехнологиите проправи пътя за изграждане на интегрирани устройства с нанометричен размер, наречени нано възли. Тези нано-възли са съставени от нано-процесор, нано-памет, нано-батерии, нано-предавател, нано-антена и нано-сензори, които работят на наномащабно ниво. Те са в състояние да изпълняват прости задачи, като усещане, изчисление и задействане. Взаимната връзка между микроустройствата и нановъзлите/наносензорите позволи разработването на нов мрежов стандарт, наречен Wireless Nano-Sensors Network (WNSN). Този документ предоставя задълбочен преглед на WNSN, неговите архитектури, области на приложение и предизвикателства, които трябва да бъдат адресирани, като същевременно идентифицира възможности за тяхното внедряване в различни области на приложение.






Електромагнитна базирана безжична нано-сензорна мрежа: архитектури и приложения
---
Този кратък фактчек не откри никакви доказателства за чип във ваксината.
Ваксинирайте се.
